酶联免疫吸附实验(ELISA)是一种广泛应用于生物医学研究中的定性或定量检测方法,它借助抗体的特异性识别功能来锁定并测量目标分子。类似于其他的免疫分析技术,ELISA既能够利用单克隆抗体和多克隆抗体,以实现对多种分析物(包括肽、蛋白质、抗体以及小分子)的精准检测。
在这个过程中,抗体的特异性是至关重要的,它确保了只有目标分析物才会被识别并结合。为了增强检测信号的强度和可见性,一部分抗体会与特定的酶(如常用的辣根过氧化物酶[HRP])进行直接或间接的偶联。这种偶联使得检测方法更为灵敏,同时还能够实现信号的放大,从而提高了检测的准确性和可靠性。
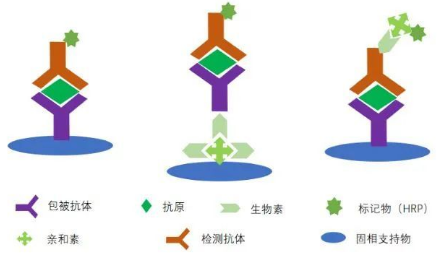
ELISA技术的灵活性还体现在其可以根据不同的实验需求和预期目标,通过多种方法以及检测化学成分的调整,来定制适合的检测方案。这使得科研能够针对单个样品进行精细的检测分析,或者在大规模筛选应用中实现高通量的样本处理。无论是基础科学研究还是临床应用开发,ELISA都展现出了其作为一种强大而可靠的检测工具的潜力。
一、直接ELISA
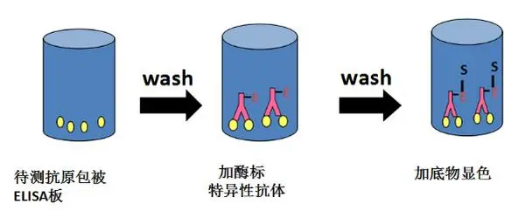
直接ELISA是一种实验技术,其中抗原直接结合在微孔板表面,并通过直接偶联的抗体进行检测。该方法简化了实验步骤,通过以下步骤展开:
实验步骤:
步骤一:抗原固定化:将抗原直接固定在微孔板上,作为实验的第一步。
步骤二:添加封闭试剂:引入封闭试剂,以防止检测抗体出现非特异性结合。
步骤三:添加直接偶联的检测抗体:将直接偶联某种酶(如HRP)的检测抗体加入。这种抗体将结合抗原,而多余的抗体将通过洗涤被移除。
步骤四:添加酶底物:引入酶底物,在短时间内孵育后,通过读板机测定每个孔的信号。
直接法优缺点:
1、优点:
1)、快速,仅使用一种抗体,步骤相对较少。
2)、消除了第二抗体的交叉反应性。
2、缺点:
1)、一抗的免疫反应性可能受到酶或标签标记的不利影响。
2)、为每个特定的ELISA系统标记一抗,费时且昂贵。
3)、由于标记的抗体密度较低,导致较低的灵敏度。
4)、抗原的固定化不是特异性的,可能引起较高的背景干扰。
二、间接ELISA
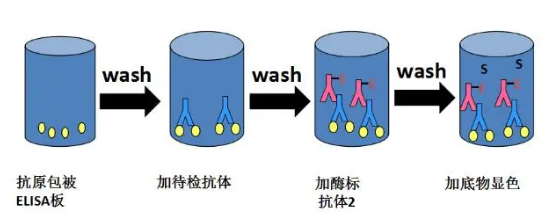
间接ELISA与直接ELISA类似,但主要区别在于引入了第二偶联抗体来检测结合抗体。实验步骤仍然从抗原固定开始,通过添加一种封闭试剂防止结合抗体的非特异性结合。
实验步骤:
步骤一:抗原固定化:将抗原固定在微孔板上,是实验的第一步。
步骤二:添加封闭试剂:防止结合抗体的非特异性结合,维护实验的特异性。
步骤三:添加抗原特异性结合抗体:加入能够与目标抗原结合的抗体,并经短暂孵育后,通过洗涤去除多余试剂。
间接检测:引入第二抗体来检测第一结合抗体。这种抗体通常与某种酶偶联。在酶底物的作用下,短暂孵育后,使用读板机测定每个孔的信号。
间接法优缺点:
1、优点:
1)、可以在一个物种中制备多个一抗,并且使用相同的标记二抗进行检测。
2)、保留了第一抗体的最大免疫反应性。
3)、高标记的二抗密度可实现高灵敏度,导致信号放大。
2、缺点:
1)、二抗可能发生交叉反应,导致非特异性信号。
2)、过程中需要额外的孵育步骤,增加实验时间。
三、夹心ELISA
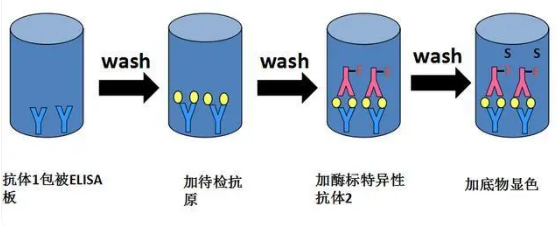
夹心ELISA是一种实验技术,其中抗原成为两种抗体之间的"三明治"中心。该方法在以下步骤中展开:
实验步骤:
步骤一:捕获抗体吸附:将第一抗体吸附在微孔板孔中,形成夹心结构。
步骤二:洗涤和封闭:在洗涤和封闭后,添加含有待检测抗原的样品。
步骤三:结合第二抗体:第二抗体结合样品中抗原的另一位点。通常,第二抗体是与某种酶偶联的抗体,用于后续检测。
步骤四:添加酶底物:在洗涤板孔之后,引入酶底物,短时间内孵育后,通过读板机测定每个孔的信号。
夹心法优缺点:
1、优点:
高特异性,使用的捕获抗体和检测抗体都具有检测特异性。
适用于复杂样品,抗原不需要进行纯化即可用于检测。
灵活性更大,灵敏度更高,可采用直接法也可采用间接法。
2、缺点:
检测物需要拥有两个以上不同的抗原表位或多个相同的重复表位。
价格较贵,耗时较多。
四、竞争ELISA
竞争性/抑制性ELISA,又被称为封闭ELISA,是一种用于定量分析物数量的方法,通过对预计信号的干扰程度进行测定。在这种实验中,一种对靶标有特异性的抗体被固定在平板上。靶标可以与某种酶结合,并用于检测。如果实验中包含的检测靶标量次于最大量,那么高浓度的未标记靶标将竞争性地结合,从而减弱信号。这种竞争性实验可用于测定某种特异性分析物的水平。
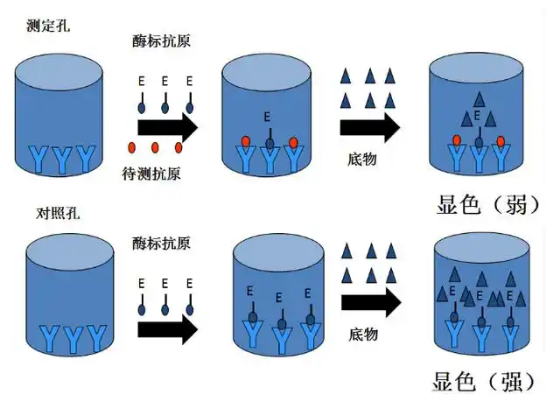
竞争法优缺点:
1、优点:
1)、高灵敏度和灵活性;
2)、能够测定微量的分析物。
2、缺点:
1)、特异性较低;
2)、需要酶标记的抗原。




