蛋白质印迹WB(Western blotting)又称免疫印迹(immunoblotting),是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术,具有SDS-PAGE的高分辨力和固相免疫测定的高特异性和敏感性,现已成为蛋白分析的一种常规技术。免疫印迹常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析。
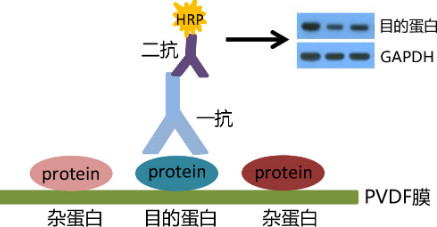
WB检测图
实验具体操作流程:
一、蛋白质样品制备
原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。
1).培养细胞或药物处理。
2).弃培养基,用1X PBS漂洗细胞2次,去尽残留培养基。
3).加入1X SDS样品缓冲液,刮落细胞,转移到Ep管。注意:冰上操作。
4).超声10~15秒剪切DNA以减低样品粘性。
5).煮沸样品5min。
6).离心12000g,5min,取上清。
二、SDS-PAGE电泳
1、清洗玻璃板
2、灌胶与上样
1). 玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶。
2). 配 10% 分离胶,加入TEMED后立即摇匀即可灌胶。灌胶时,可用10ml枪吸取5ml 胶沿玻璃放出,待胶面升到绿带中间线高度时即可。然后胶上加一层水,液封后的胶凝的更快。
3). 当水和胶之间有一条折射线时,说明胶已凝了。再等3min使胶充分凝固就可倒去胶上层水并用吸水纸将水吸干。
4). 配 4% 的浓缩胶, 加入 TEMED 后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。待到浓缩胶凝固后,两手分别捏住梳子的两边竖直向上轻轻将其拔出。
5). 用水冲洗一下浓缩胶,将其放入电泳槽中。
6). 在电泳槽的上、下槽中加入1×Tris-甘氨酸或SDS电泳缓冲液,上样。
7). 连接电泳槽到电泳仪。上槽接负极,下槽接正极,通电起始电压70~ 80V,10min后100V,电泳2h或当溴酚蓝迁移至离底部1cm时,停止电泳。
三、转膜
1). 将胶浸于转移缓冲液中平衡 10min。 注意:若检测小分子蛋白,可省略此步,因小分子蛋白容易扩散出胶。
2). 依据胶的大小剪取膜和滤纸6 片, 放入转移缓冲液中平衡10min。 如用PVDF 膜需用纯甲醇浸泡饱和 3-5 秒钟。
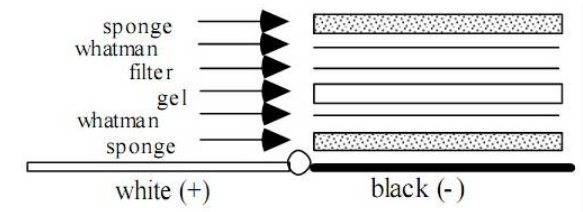
3). 装配转移三明治:海绵3层滤纸胶膜,3层滤纸海绵,每层放好后,用试管赶去气泡。切记:胶放于负极面(黑色面)。
4)、 将转移槽置于冰浴中,放入三明治(黑色面对黑色面),加转移缓冲液, 插上电极,100V,1h(电流约为 0.3A)。
5). 转膜结束后,切断电源,取出杂交膜。
四、封闭与杂交
1).用25ml TBS 洗膜5min,室温,摇动。
2).置膜于25ml 封闭缓冲液中1h, 室温,摇动。
3).15mlTBS/T洗3次(5min/T)。
4).加入合适稀释度的一抗,室温孵育1-2h或4°C过夜,缓慢摇动。
5).15ml TBS/T洗3次(5min/T)。
6).加入合适稀释度的碱性磷酸酶(AP)或辣根过氧化酶(HRP)标记的二抗,室温孵育1h,缓慢摇动。
7).15ml TBS/T洗3次(5min/T)。
8).15ml TBS洗1次。
五、显色
将 A、B 发光液按比例稀释混合。膜用去离子水稍加漂洗,滤纸贴角吸干,反贴法覆于 A、B 混合液滴上,熄灯至可见淡绿色荧光条带(5min 左右)后滤纸贴角吸干,置于保鲜膜内固定于片盒中,迅速盖上胶片,关闭胶盒,根据所见荧光强度曝光。取出胶片立即完全浸入显影液中 1~2min,清水漂洗一下后放在定影液中至底片完全定影,清水冲净晾干,标定Marker,进行分析与扫描。
免疫印迹(WB)实验具体操作流程
发布日期:2024/11/7 13:23:00
上一篇:抗体在实验技术中的应用技巧
下一篇:实验常用的细胞染色方法操作及注意事项




